Publié le 03 juin 2022Lecture 7 min
Traitement de la fibrose pulmonaire idiopathique
Jean-Marc NACCACHE, Chef du service de pneumologie, allergologie et oncologie thoracique, Groupe hospitalier Paris-Saint-Joseph, Paris
La fibrose pulmonaire idiopathique (FPI) est la plus sévère des pneumopathies interstitielles. L’avènement des antifibrosants constitue l’innovation thérapeutique la plus importante des dix dernières années. Par ailleurs, la prise en charge de la FPI va des traitements symptomatiques à la transplantation pulmonaire. Elle est aujourd’hui bien codifiée et a fait l’objet en 2021 d’un protocole national de diagnostic et de soins (PNDS) dont l’article est largement inspiré.
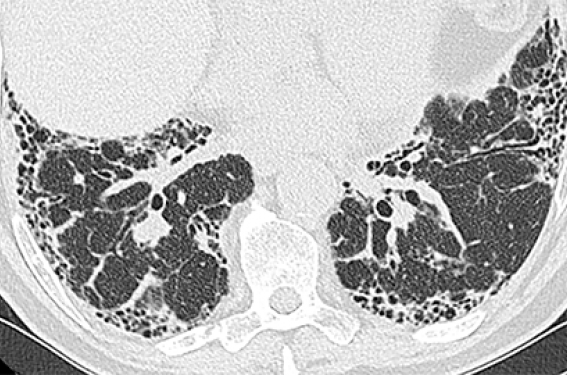
La FPI est la forme la plus fréquente de pneumopathie interstitielle diffuse (PID) idiopathique chronique chez l’adulte. Il s’agit d’une pathologie chronique, irréversible, de cause inconnue, limitée aux poumons, caractérisée histologiquement et radiologiquement par un aspect de pneumopathie interstitielle commune (PIC). Sur le plan histologique, cela correspond à une destruction architecturale avec un excès de matrice extracellulaire constituant la fibrose qui est prédominante en sous-pleural et/ou en para-septal. Il s’y associe des foyers fibroblastiques à l’origine de cette fibrose. Sur le plan radiologique, cela correspond typiquement à des images en rayon de miel à prédominance basale et sous-pleurale (figure1)(1).
En France, on estime sa prévalence à 8,2/100 000 habitants (environ 5 500 patients) et son incidence annuelle à 2,8/100 000 habitants (environ 1 800 nouveaux cas par an). Il s’agit d’une maladie qui touche principalement les hommes, fumeurs et se manifeste le plus souvent après l’âge de 50 ans.
La prise en charge de la FPI a fait l’objet d’un protocole national de diagnostic et de soins (PNDS) publié en 2021 dans le cadre du centre de référence des maladies pulmonaires rares (Orphalung) au sein de la filière maladie respiratoire rare (RESPIFIL)(2).
Le diagnostic de la FPI repose sur des arguments cliniques, radiologiques, biologiques et parfois histopathologiques. Il nécessite une discussion multidisciplinaire associant des pneumologues, radiologues, anatomopathologistes, et parfois rhumatologues et/ou internistes.
Les symptômes de la FPI sont principalement représentés par la dyspnée et la toux. L’évolution est progressive avec l’apparition de signe d’insuffisance respiratoire et d’insuffisance cardiaque droite. Il peut survenir à des degrés variables notamment en fonction de la gravité de la maladie, une altération de l’état général, un amaigrissement ainsi qu’un retentissement psychologique à type d’anxiété et de dépression. Le pronostic est péjoratif et est mieux apprécié en calculant le score de GAP (tableaux 1 et 2). La surveillance de l’évolution de la FPI est basée sur la clinique et sur les explorations fonctionnelles respiratoires dont les éléments les plus importants sont la capacité vitale forcée (CVF) et la capacité de diffusion du monoxyde de carbone (DLco). D’éventuelles exacerbations aiguës (cf. infra) viennent aggraver le pronostic.
Le traitement médicamenteux de la FPI repose principalement sur les traitements antifibrosants, seuls médicaments qui ont fait la preuve de leur efficacité dans le ralentissement de la maladie.
Deux médicaments antifibrosants ont obtenu récemment l’AMM : la pirfénidone (Esbriet®) en 2011 et le nintedanib (Ofev®) en 2015. Ils sont indiqués dans les formes légères à modérées avec des mécanismes d’action différents, mais une efficacité comparable. Ils diminuent environ de moitié le déclin de la CVF au cours du temps et diminuent le risque d’exacerbation aiguë. Le tableau 3 issu du PNDS reprend les modalités pratiques des antifibrosants avec leurs contre-indications et principaux effets indésirables.
La pirfénidone a un effet antifibrosant en limitant la production de facteurs de croissance profibrosants dont le TGFbêta. Elle a aussi des propriétés anti-inflammatoires et antioxydantes.
La posologie de pirfénidone est de 1 comprimé à 801 mg, 3 fois par jour après une augmentation progressive sur les premières semaines de traitement en utilisant des comprimés dosés à 267 mg.
Les événements indésirables les plus fréquents comprennent des troubles digestifs (nausées, anorexie), une fatigue, des vertiges, et des manifestations cutanées (photosensibilité, éruption cutanée). L’élévation des transaminases qui concerne environ 2,5 % des patients et certaines formes graves d’hépatite justifient un contrôle du bilan hépatique préthérapeutique, mensuel les six premiers mois de traitement puis trimestriel pendant toute sa durée.
Concernant les précautions d’emploi, Il existe des interactions médicamenteuses à éviter avec les inhibiteurs du cytochrome P450 1A2 (ex. : fluvoxamine, jus de pamplemousse) ainsi qu’avec les inducteurs enzymatiques (ex. : tabac, oméprazole). Surtout il est indispensable d’éviter toute exposition solaire du fait de la photosensibilité (port de vêtements couvrant, chapeau à larges bords, lunettes de soleil, chemise à manches longues, pantalons longs, gants pour les activités de plein air et la conduite automobile, écran solaire indice de protection élevé).
Le nintedanib est un inhibiteur de tyrosine kinase dont celle associée au récepteur du PDGF (platelet derived growth factor), du FGF (fibroblast growth factor) et du VEGF (vascular endothelial growth factor). Par cette activité, il modifie le métabolisme des fibroblastes.
La posologie de nintedanib est de 1 comprimé à 150 mg matin et soir.
Les événements indésirables les plus fréquents sont digestifs (diarrhée, nausée, vomissements) et peuvent être améliorés par des règles hygiéno-diététiques adéquates et/ou certains traitements notamment antidiarrhéiques. Les risques d’augmentation des transaminases justi-fient, comme pour la pirfénidone, un contrôle du bilan hépatique préthérapeutique, mensuel les six premiers mois de traitement puis trimestriel pendant toute sa durée.
La pirfénidone et le nintédanib sont à prescription hospitalière. Certains effets indésirables dont les perturbations du bilan hépatique nécessitent parfois une diminution de la posologie ou un arrêt de traitement qui peut être temporaire ou définitif(2).
Les traitements antifibrosants ont peu d’effet sur les symptômes qui doivent être pris en charge spécifiquement.
La toux est plus ou moins invalidante. Il est important de rechercher une cause de toux qui pourrait être améliorée par un traitement adapté (ex. : reflux gastro-œsophagien). Certains médicaments peuvent être tentés tels une corticothérapie à faible dose (10mg/jour), la gabapentine (traitement antiépileptique) ou un traitement morphinique à faible dose. L’évaluation de l’efficacité de ces traitements est indispensable pour décider de leur poursuite du fait de leurs potentiels effets indésirables.
La dyspnée peut être améliorée par la réhabilitation respiratoire et l’oxygénothérapie de déambulation en cas de désaturation à l’effort. L’oxygénothérapie de repos est indiquée selon les mêmes critères qu’au cours de l’insuffisance respiratoire chronique : PaO2 ≤ 55 mmHg (7,3 kPa) (soit SaO2 ≤ 88 %) mesurée au repos en état stable à deux reprises ; ou PaO2 entre 55-60 mmHg (7,3-8,0 kPa) en présence de l’un au moins des critères suivants : polyglobulie (hématocrite > 55 %), signes d’hypertension pulmonaire, signes documentés d’insuffisance cardiaque droite, désaturations nocturnes non apnéiques. Enfin, les dérivés morphiniques à faible dose peuvent aussi être utilisés pour améliorer la dyspnée.
Les conséquences de la FPI sur l’état général et son retentissement psychologique doivent faire l’objet d’un accompagnement des malades sur le plan psychologique, nutritionnel et médico-social.
Dans ce contexte, il faut signaler le rôle de l’association des patients APEFPI (association Pierre Enjalran Fibrose Pulmonaire Idiopathique) qui peut être un support et orienter les patients sur l’ensemble du territoire français (https://fpi-asso.com/).
La surveillance des patients présentant une FPI vise à prendre en charge les complications, dont la progression de la maladie et les comorbidités.
En cas de progression de la maladie sous antifibrosant, on peut changer de médicament antifibrosant. Il faut aussi envisager l’inclusion dans un des protocoles thérapeutiques qui sont en cours dans les centres de compétence ou de référence constitutifs des maladies pulmonaires rares.
Dans les formes sévères, la transplantation pulmonaire peut être envisagée en fonction de l’âge (classiquement moins de 65 ans) et en l’absence de comorbidité jugée significative par un centre de transplantation qui doit évaluer précocement le patient.
L’exacerbation aiguë de fibrose pulmonaire idiopathique (EA- FPI) est une complication caractérisée par une aggravation clinique aiguë évoluant typiquement depuis moins de 30 jours associée à l’apparition de nouvelles opacités parenchymateuses en verre dépoli ou à type de condensation bilatérale sans signe de surcharge hydrosodée. Elle est responsable d’un pronostic très péjoratif avec une mortalité à trois mois, évaluée à plus de 50 %. Aucun traitement n’a fait la preuve de son efficacité. Le traitement actuellement recommandé repose sur des corticoïdes à fortes doses. Cependant, l’inefficacité de la cyclophosphamide prouvée dans l’essai français EXAFIP incite à confirmer l’efficacité de la corticothérapie(3). Ce traitement sera très bientôt évalué dans le nouvel essai thérapeutique EXAFIP 2. Cet essai sera disponible dans les centres de compétence ou de référence constitutifs des maladies pulmonaires rares. La transplantation pulmonaire peut être indiquée en urgence dans un contexte d’EA-FPI.
L’étude EXAFIP réalisée sous l’égide d’Orphalung a prouvé l’inefficacité du cyclophosphamide au cours des EA-FPI. La nouvelle étude EXAFIP2 doit débuter dans les prochains mois et évaluera l’efficacité de la corticothérapie à forte dose.
L’hypertension pulmonaire est une complication de la FPI dans sa forme évoluée. Les traitements spécifiques de l’hypertension pulmonaire ne sont pas recommandés à ce jour au cours de la FPI, mais il est important d’en faire le bilan pour éliminer une cause potentiellement améliorable (ex. : maladie thrombo-embolique).
Les complications infectieuses notamment la grippe, les pneumopathies à pneumocoque et la Covid-19 sont responsables d’une importante morbi-mortalité au cours de la FPI et leur prévention passe par la vaccination(4).
Les comorbidités les plus fréquentes à rechercher et à prendre en charge selon leurs modalités habituelles sont les maladies cardiovasculaires, le reflux gastro-œsophagien et le syndrome d’apnée du sommeil.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :