Publié le 05 jan 2015Lecture 8 min
Quels biomarqueurs pour le suivi de l’asthme ?
L. GIOVANNINI-CHAMI, Pneumo-allergologie pédiatrique, hôpitaux pédiatriques de Nice CHU-Lenval ; Université de Nice Sophia Antipolis
Le suivi de l’asthme est actuellement basé sur les symptômes et les données spirométriques. Quelle place alors pour les biomarqueurs dans ce suivi ? Les biomarqueurs utilisés en routine semblent ne pas avoir tenu leurs promesses. De nouvelles mesures biologiques arrivent et permettent d’envisager une stratification des malades pour des thérapeutiques ciblées.
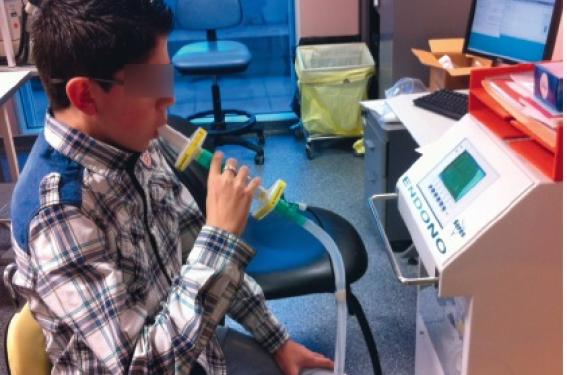
Le suivi de l’asthme est actuellement basé selon les recommandations internationales sur les symptômes et les données spirométriques qui permettent d’évaluer le contrôle de la pathologie. Or l’asthme est une pathologie inflammatoire chronique dans laquelle le monitorage direct des différents endotypes, à l’aide de biomarqueurs précis, permettrait d’adapter au plus près la prise en charge médicamenteuse. Cette approche est cruciale notamment dans la prise en charge des asthmes sévères où le développement de thérapeutiques extrêmement coûteuses nécessitera une stratification rigoureuse des patients éligibles et un monitoring précis pour mesurer leur impact. Qu'est-ce qu'un biomarqueur ? Un biomarqueur est un signe physique ou une mesure biologique qui sert d’indicateur d’un processus physiopathologique ou d’une réponse à une intervention pharmacologique. Les biomarqueurs peuvent donc à la fois être utiles au diagnostic, au phénotypage d’une pathologie, au suivi de la progression de cette dernière, ou encore au suivi de la réponse à un traitement spécifique. Le biomarqueur idéal doit donc remplir un cahier des charges précis. Un lien clair entre ce dernier et la physiopathologie de la maladie doit être tout d’abord établi. Il ne doit pas varier de manière circadienne. La méthode de recueil doit être simple et acceptable par le patient. De plus, le biomarqueur doit être simple à quantifier, d’un coût convenable, sensible, spécifique, fiable et reproductible. Les biomarqueurs actuellement disponibles L’asthme étant communément défini comme une pathologie inflammatoire chronique, les premiers biomarqueurs étudiés correspondent à des marqueurs d’inflammation Th2. NO exhalé Le NO est un gaz produit au niveau des voies aériennes supérieures et inférieures par de nombreux types cellulaires (cellules épithéliales, macrophages, fibroblastes, pneumocytes de type 2). La technique de mesure du NO exhalé (FeNO) est de réalisation simple, non invasive, reproductible et de plus en plus diffusée (figure). La production de NO endogène s’effectue lors de l’oxydation de la L-arginine en L-citrulline par les NO synthases. Cette production est sous la dépendance de nombreuses cytokines et médiateurs pro-inflammatoires, notamment l’histamine pour les NO synthases constitutionnelles, mais également l’IL-4, l’IFN-gamma et les endotoxines pour les NO synthases inductibles. Les taux de NO exhalés sont corrélés à l’éosinophilie dans le sputum et les biopsies bronchiques. Pour autant, de nombreux triggers inflammatoires, notamment infectieux, induisent la production de NO. Sa sensibilité et sa spécificité ne sont donc pas parfaites, avec notamment une augmentation significative de FeNO en cas d’infection virale et une diminution en cas de tabagisme passif ou actif. • Peut-on utiliser le FeNO pour guider le choix d’un traitement anti-asthmatique ? L’étude CLIC(1) a montré dans l’asthme léger à modéré que les patients répondant plus favorablement aux corticoïdes inhalés (CSI) qu’au montelukast sont ceux qui ont un FeNO élevé. Le FeNO semble donc pouvoir constituer un marqueur de corticosensibilité, ce que confirment les recommandations ATS de 2011(2). L’étude BADGER(3) s’est proposée d’analyser les facteurs intervenant dans une réponse différentielle dans différents schémas de majoration thérapeutique chez des enfants non contrôlés par de la fluticasone propionate 100 µg 2 fois/j. Ces schémas correspondaient à la majoration des doses de corticoïdes inhalés (CSI), l’adjonction de bronchodilatateurs de longue durée d’action ou d’antileucotriènes. Le FeNO n’apporte dans ce cadre aucune aide décisionnelle. • Peut-on utiliser le FeNO comme marqueur de contrôle de l’asthme ? Deux métaanalyses de 2012 ont colligé les études pédiatriques randomisées, contrôlées, concernant la titration des doses de CSI par mesures répétées de FeNO(4,5). De ce type de prise en charge découle une majoration statistiquement significative des doses de CSI par rapport à une prise en charge conventionnelle. D’autres auteurs ont également montré que le FeNO ne peut pas être utilisé comme marqueur de contrôle ou de sévérité au début de la prise en charge ou au cours du suivi du patient. Il pourrait être utilisé comme marqueur d’observance, avec une diminution significative des niveaux à l’introduction d’une corticothérapie inhalée. La limite de ce type d’approche est la spécificité de la mesure avec l’intrication des infections virales en pédiatrie. Le FeNO peut, par contre, prédire le risque de rechute en phase de réduction d’une corticothérapie. L’ATS propose de l’utiliser pour « monitorer » l’inflammation des voies aériennes des patients en définissant des seuils de variation significatifs. Éosinophiles dans l’expectoration Sur le plan physiopathologique, le lien semble clair et établi, mais il existe notamment dans l’asthme sévère des profils d’asthme non pas éosinophiliques mais neutrophiliques. La méthodologie est semi-invasive, avec recueil des expectorations induites par des nébulisations de sérum salé hypertonique. Cette technique est compliquée à mettre en œuvre, moins répandue et non réalisable chez les plus jeunes. La sensibilité, la spécificité et la reproductibilité de cette technique semblent également défavorables avec l’intrication de modifications des profils induites par les virus et l’absence de reproductibilité dans le temps des mesures(6). Les métaanalyses étudiant l’impact de l’étude de l’éosinophilie dans les expectorations dans l’adaptation de la prise en charge montrent chez les adultes une diminution de la fréquence des exacerbations sans augmentation corollaire de la dose de CSI(4). Chez l’enfant, les études s’avèrent rares et moins prometteuses, avec un effet uniquement sur le nombre d’exacerbations dans les 28 jours suivant la mesure, sans impact sur le nombre annuel d’exacerbations(7). Les biomarqueurs du futur ? Les leucotriènes urinaires La mesure de ces derniers est simple. Les LTE4 ou le ratio LTE4/FeNO prédisent une meilleure réponse au montelukast chez les enfants ayant un asthme léger à modéré. Il n’y a pas d’étude à l’heure actuelle sur l’apport des LTE4 dans le suivi. Les condensats exhalés Les condensats exhalés représentent la phase liquide de l’air exhalé et sont recueillis en le refroidissant. Ces condensats sont censés refléter la composition du liquide de surface des voies aériennes (substances non volatiles, substances volatiles gazeuses). La méthodologie de recueil est facile mais pas standardisée, et la mesure des biomarqueurs est encore en phase expérimentale. Cette technique permet de discriminer les enfants asthmatiques des témoins, mais n’a pas été étudiée dans le suivi des patients. Les composés organiques volatils Les composés organiques volatils sont issus du stress oxydatif et de la peroxydation lipidique : ils sont donc l’un des reflets de l’inflammation. Des nez électroniques portables permettent le recueil de ces derniers. Cette technique permet de distinguer les enfants asthmatiques des témoins, mais n’a pas été étudiée dans le suivi des patients. La périostine La périostine est un composant de la matrice extracellulaire produite par les cellules épithéliales, stimulée par cytokines Th2 et corticosensible. Elle induit la production de cytokines pro-inflammatoires Th2 comme le TSLP. Il s’agit donc d’une protéine au cœur de l’inflammation Th2. La méthodologie de prélèvement est simple : un prélèvement sérique. Sa sensibilité et sa spécificité semblent satisfaisantes, son niveau d’expression n’étant en effet pas modifié par les infections virales, ni par le tabac. La périostine permet de phénotyper les adultes asthmatiques en Th2 « high » et « low »(8). Chez l’enfant, la périostine permet de distinguer les enfants ayant une rhinite allergique, isolée ou associée à un asthme, des témoins, mais également les asthmes non contrôlés des asthmes contrôlé(9). Ce nouveau biomarqueur permet de différencier les patients asthmatiques non contrôlés répondant aux Ac anti-IL13 (Lebrikizumab®), avec une amélioration du VEMS de 5,5 % sur l’ensemble de la cohorte, de 8,2 % dans le high periostin subgroup et de 1,6 % dans le low periostin subgroup(10). Il s’agit réellement d’un nouveau biomarqueur sérique. Dans une étude comportant des adultes symptomatiques malgré traitement maximal par CSI, la périostine est le marqueur ayant la meilleure corrélation avec l’éosinophilie des voies aériennes (CSI)(11). En pratique Les biomarqueurs actuels : NO et éosinophiles dans l’expectoration induite, n’ont pas tenu leurs promesses dans le suivi de l’asthme. L’adaptation du traitement en fonction de ces biomarqueurs ne s’avère pas probante, entraînant dans le cas du NO exhalé un dosage excessif de corticoïdes inhalés. Comme montré dans l’étude BASALT chez l’adulte, une stratégie incluant le NO exhalé n’est pas supérieure au jugement seul du clinicien. La périostine semble être par contre un nouveau biomarqueur prometteur, car elle permet de définir des sous-groupes de malades éligibles à des nouveaux types de thérapeutiques coûteuses, les biothérapies anti-Th2. Les nouveaux biomarqueurs devront répondre à la double contrainte de stratification des malades et de possibilité de suivi de l’impact des différentes thérapeutiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :