Publié le 27 mai 2019Lecture 7 min
Fibrose pulmonaire idiopathique : les complications
Mallorie KERJOUAN et coll.*, service de pneumologie, Centre de compétences pour les maladies pulmonaires rares, Hôpital Pontchaillou, Rennes
La fibrose pulmonaire idiopathique (FPI) est une maladie chronique et incurable (hors transplantation pulmonaire) d’évolution imprévisible. Sa physiopathologie n’est pas encore totalement élucidée. Le score pronostique GAP (Gender – Age – Physiology) est validé et fournit des chiffres de mortalité à 1, 2 et 3 ans du diagnostic.
De nombreuses complications peuvent survenir chez les patients atteints de FPI : toux, excerbation aiguë de FPI, hypertension pulmonaire, RGO, cancer bronchopulmonaire ou syndrome d’apnées du sommeil. La connaissance de ces événements est importante, car elle permettra un diagnostic rapide le cas échéant et une prise en charge optimisée.
Introduction
La fibrose pulmonaire idiopathique (FPI) est la plus fréquente des pneumopathies infiltrantes diffuses (PID) idiopathiques chroniques de l’adulte(1). La FPI est une maladie rare, avec une prévalence en France estimée à 9 000 cas et une incidence de l’ordre de 4 400 nouveaux cas par an. La FPI touche plus les hommes que les femmes (sex ratio de 1,5 à 1,7/1) et sa survenue augmente avec l’âge, la FPI étant rare avant 60 ans(2). Sa physiopathologie n’est pas clairement élucidée, mais les principaux facteurs de risque sont l’exposition à la fumée de cigarette et aux poussières de bois ou de métal(3).
Histoire naturelle de la FPI et pronostic
La FPI est une maladie chronique, incurable (hors transplantation pulmonaire), s’aggravant progressivement, de manière inéluctable, mais de façon imprévisible (figure 1).
Figure 1. Evolution de la FPI(4).
Certains patients présentent en effet un déclin progressif et lent de leur fonction respiratoire, alors que d’autres s’aggravent très rapidement à l’occasion de « poussées » de la maladie appelées exacerbations de FPI (cf. chapitre complications de la FPI). Globalement, la médiane de survie des patients atteints de FPI serait de 3 ans après e diagnostic(4). Cependant, cette notion mériterait d’être revue car ce chiffre est issu d’une étude s’intéressant à des patients qui n’avaient pas bénéficié des traitements anti-fibrosants spécifiques récemment mis sur le marché et utilisés aujourd’hui en pratique courante. Les facteurs associés à une augmentation de la mortalité liée à la FPI sont(5) :
– facteurs démographiques : âge, sexe masculin ;
– signes et symptômes initiaux : importance de la dyspnée, DLCO (capacité de diffusion du CO) 5 % en valeur absolue ou 10 % de la valeur théorique en 6 mois, diminution de la DLCO > 15 % en valeur absolue ou théorique en 6 mois, diminution de la distance au TM6 > 50 m, aggravation de la fibrose sur le scanner thoracique.
Les paramètres fonctionnels respiratoires que sont la CVF et la DLCO, associés à l’âge et au sexe du patient, composent le score pronostique GAP, qui permet une estimation de la mortalité à 1, 2 et 3 ans (tableaux 1 et 2)(6). Le calculateur GAP est disponible en ligne (http://www.acponline.org/journals/annals/extras/gap/)(6).
Complications de la FPI
De nombreuses complications peuvent apparaître lors du suivi des patients atteints de FPI.
• La toux sèche invalidante peut motiver une corticothérapie à faible dose en cas d’inefficacité de la codéine. Du fait de la fréquence du tabagisme et de l’âge élevé des patients, les comorbidités cardiovasculaires sont fréquentes.
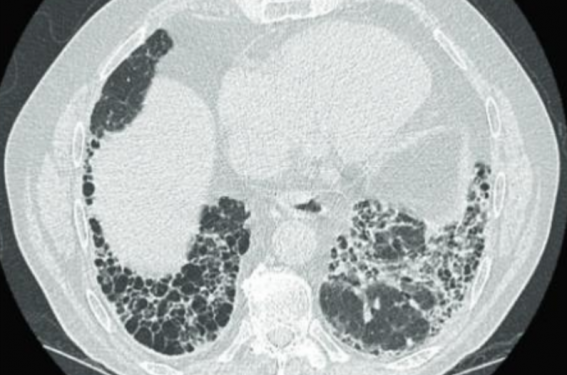
• Des exacerbations aiguës (EA) de FPI sont également à craindre (figure 2). Chaque année, approximativement 10 à 20 % des patients atteints de FPI présentent une EAFPI(7). Sa définition actuelle est une aggravation rapide de la dyspnée, classiquement sur moins de 1 mois, avec l’apparition de nouvelles images bilatérales en verre dépoli. L’EAFPI peut ne pas avoir de cause retrouvée (elle est alors idiopathique), mais peut aussi survenir dans un contexte particulier : infectieux ou post-infectieux, thromboembolique (nécessité de réaliser un dosage de D-dimères et/ou un angioscanner thoracique, figure 3) ou cardiaque (nécessité de doser les NT-proBNP et/ou réaliser une échocardio graphie)(8). Le pronostic de ces EAFPI est excessivement sombre, avec une médiane de survie de 3 à 4 mois. Des facteurs de risques d’EAFPI ont été identifiés : une CVF et une DLCO basses, une faible distance parcourue au test de marche de 6 minutes, une hypertension pulmonaire. Le traitement actuellement proposé est une corticothérapie systémique à forte dose. Un essai thérapeutique contre placebo est en cours (EXAFIP), testant l’ajout du cyclophosphamide à la corticothérapie. Les inclusions de cet essai ont été clôturées en juillet 2018.
Figure 2. Scanner thoracique d’une patiente ayant présenté une exacerbation aiguë de FPI. Colonne de gauche en vert, scanner thoracique au diagnostic de FPI. Colonne de droite en rouge, scanner thoracique au diagnostic de l’exacerbation aiguë de FPI avec l’apparition d’images bilatérales en verre dépoli.
Figure 3. Angioscanner thoracique d’un patient qui présentait une dyspnée rapidement progressive sur 2 semaines sans facteur déclenchant retrouvé, évocateur d’une EA FPI. Les coupes parenchymateuses retrouvent de nouvelles images en verre dépoli aux deux bases. Cependant, cet examen met en évidence une embolie pulmonaire (EP) proximale multifocale. Il est donc bien indispensable d’éliminer l’EP devant toute suspicion d’EA FPI.
• L’hypertension pulmonaire (HTP) peut être secondaire à la FPI, surtout en cas d’emphysème associé, mais doit faire éliminer une embolie pulmonaire, une insuffisance cardiaque gauche et un syndrome d’apnées obstructives du sommeil (SAOS). Le traitement principal consiste en la supplémentation en oxygène lorsque la PAO2 est inférieure à 60 mmHg. Les traitements vasodilatateurs artériels spécifiques de l’HTP ne sont pas indiqués, sauf dans le cadre d’essais thérapeutiques spécifiques(5,7). La transplantation pulmonaire ou cardiopulmonaire doit être envisagée selon l’âge et les comorbidités(5).
• Le reflux gastro-œsophagien (RGO), avec ou sans hernie hiatale (figure 4) est fréquemment associé à la FPI. Selon les recommandations françaises, il est proposé de rechercher à l’interrogatoire un antécédent ou des symptômes de RGO chez les patients avec un diagnostic confirmé de FPI. Lorsqu’il existe une suspicion de RGO, il est proposé de l’explorer et de le traiter(5).
• Le cancer bronchopulmonaire (CBP) (figure 5), fréquent dans cette population notamment en cas d’emphysème associé(9), pose des problèmes diagnostiques et thérapeutiques du fait de la FPI sous-jacente. Les cancers épidermoïdes seraient plus fréquents que les adénocarcinomes. Dans une récente étude rétrospective de cohorte, la prévalence du CBP histologiquement prouvé chez les patients atteints de FPI était de 13 % et l’incidence cumulée atteignait 41 % à 1 an et 82 % à 3 ans(10). Les données disponibles ne permettent pas de recommander une prise en charge spécifique du CBP au cours de la FPI(5).
Une des difficultés est représentée par le risque d’EAFPI lors des traitements du cancer (chirurgie, radiothérapie, chimiothérapie).
Figure 4. Scanner thoracique d’un patient avec FPI et hernie hiatale souffrant de RGO.
Figure 5. Scanner thoracique d’un patient atteint d’un syndrome combinant emphysème des sommets et fibrose des bases (FPI) qui présente un cancer bonchopulmonaire secondairement prouvé histologiquement par ponction sous scanner. La flèche bleue correspond à la masse lobaire inférieure droite, la flèche rouge à l’adénopathie sous carinaire.
• Il semble que le syndrome d’apnées obstructives du sommeil (SAOS) ait une fréquence élevée chez les patients atteints de FPI. L’interrogatoire est moins sensible que la polysomnographie pour établir le diagnostic(5). Il n’existe pas de données permettant de formuler une recommandation relative au traitement du SAOS chez les patients atteints de FPI. Le traitement par pression positive continue semble efficace et pourrait améliorer la qualité de vie des patients.
Des complications cardiovasculaires peuvent également survenir chez ces patients très souvent fumeurs ou anciens fumeurs.
Enfin, il ne s’agit pas d’une complication, mais il faut savoir répéter le bilan auto-immun et savoir reconsidérer le diagnostic de FPI en cas d’évolution de la symptomatologie. Par exemple, chez un patient avec atteinte pulmonaire à type de PIC, l’apparition secondaire de polyarthralgies inflammatoires et destructrices avec positivité secondaire des facteurs rhumatoïdes et/ou anti-CCP amènera au diagnostic de polyarthrite rhumatoïde, et le développement secondaire d’un purpura et d’une glomérulopathie avec positivité secondaire des ANCA anti-MPO posera le diagnostic de polyangéite microscopique.
En pratique : suivi d’un patient atteint de FPI
Les recommandations françaises proposent la réalisation d’une radiographie thoracique et d’épreuves fonctionnelles respiratoires, afin d’évaluer la CVF et la DLCO, tous les 3 à 6 mois(5).
D’autres examens de réalisation annuelle sont à discuter :
– scanner thoracique, avec ou sans injection de produit de contraste en fonction de l’indication, avec une attention particulière à la recherche de cancers, notamment chez les patients en capacité de recevoir un traitement (i.e. formes légères de FPI) ;
– échographie cardiaque avec Doppler ;
– capacité pulmonaire totale ;
– TM6 ;
– voire cathétérisme cardiaque droit, si la présence d’une HTP peut conduire à des thérapeutiques intéressantes.
En parallèle, d’autres examens peuvent être réalisés en fonction de l’évolution clinique, notamment la répétition du bilan auto-immun ou la polygraphie nocturne.
Synthèse
La fibrose pulmonaire idiopathique est une maladie rare, incurable et de mauvais pronostic, dont la physiopathologie n’est pas complètement élucidée à l’heure actuelle. L’âge, le sexe masculin, des symptômes importants lors du bilan initial ou du suivi, des paramètres fonctionnels ou scanographiques altérés sont autant de facteurs de risque de mortalité, cette dernière pouvant être estimée avec le score GAP. Les complications à rechercher au cours du suivi sont le cancer bronchopulmonaire, l’HTP, le RGO et le SAOS, mais également les événements liés au terrain, comme les complications cardiovasculaires. Chez les patients atteints de PIC radiologique et/ou histologique et classés « FPI », la recherche de maladie systémique doit être systématique et répété lors du suivi, afin de ne pas méconnaitre une PID associée à une connectivite ou vascularite, dont le pronostic est meilleur que celui de la FPI.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :