Pneumologie
Publié le 07 mai 2024Lecture 10 min
La dilatation de bronches : une maladie méconnue, mais invalidante - Quels principes de prise en charge ? Une maladie et un impact sous-estimés
Marlène MURRIS-ESPIN, service de pneumologie, CRCM adulte, transplantation pulmonaire,Hôpital Larrey, CHUde Toulouse
Méconnue du grand public, cette maladie inflammatoire chronique bronchique peut concerner enfants et adultes. Sa prévalence augmente avec l’âge et chez la femme ; elle a longtemps été sous-estimée et augmente dans les pays occidentaux, pouvant aller jusqu’à plus de 500 cas pour 100 000 habitants(1). Un retard de diagnostic est fréquent. Elle est source de morbidité et de mortalité (respiratoire et extra-respiratoire). Les symptômes peuvent altérer lourdement la qualité de vie. Sa présentation est très hétérogène(2) allant d’une petite toux quotidienne à une bronchorrhée invalidante, variable d’un jour à l’autre, à des exacerbations respiratoires fréquentes par surinfections bronchiques, conduisant à une dégradation de la fonction respiratoire. Elle est encore trop fréquemment confondue avec une BPCO (chez un patient souvent non fumeur) ou un asthme, ce qui conduit à une prise en charge inadaptée, même si les deux pathologies peuvent être associées.
Depuis quelques années, la physiopathologie est mieux comprise. Elle repose sur 4 composants qui contribuent au cercle vicieux (ou « Vortex ») (figure 1) et seront des cibles thérapeutiques : infection (virale, bactérienne, mycobactérienne, fongique), inflammation bronchique, clairance muco-ciliaire altérée, et atteinte bronchique morphologique.
Figure 1. Un socle thérapeutique pour rompre un cercle vicieux physiopathologique.
LE DIAGNOSTIC DE BRONCHECTASIES EST FACILE
Il repose sur l’association :
– signes cliniques : toux et expectoration quotidiennes et infections respiratoires récidivantes ;
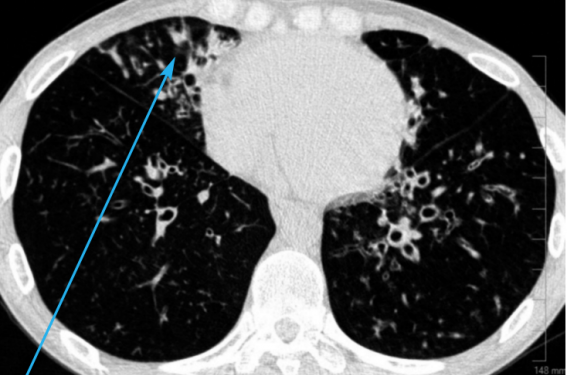
– signes tomodensitométriques thoraciques : une augmentation permanente et irréversible du calibre des bronches sous-segmentaires sur un scanner thoracique en haute résolution sans injection de produit de contraste)(figure 2).
1. Le signe de la « bague à chaton » : le diamètre bronchique est supérieur au diamètre de l’artère associée.
2. Une absence de réduction progressive du calibre bronchique en s’éloignant du hile.
3. Des bronches visualisées au niveau du tiers externe du parenchyme (touchant parfois la plèvre costale ou médiastinale). Peuvent s’y associer des impactions mucoïdes, témoins du comblement endobronchique.
Foyer bronchectasies kystiques isolées, en territoire sous-pleural.
Bronches visualisées au niveau du tiers externe du parenchyme pulmonaire.
Signe de la « bague à chaton » : le diamètre bronchique est supérieur au diamètre de l’artère associée aux bronches visualisées au niveau du tiers externe du parenchyme pulmonaire.
Impactions mucoïdes.
Absence de réduction progressive du calibre bronchique en s’éloignant du hile.
La radiographie thoracique sous-estime les images de bronchectasies. Le scanner permet d’affirmer le diagnostic.
Figure 2. Les 3 grands signes tomodensitométriques des bronchectasies.
La radiographie thoracique n’a aucun intérêt pour poser le diagnostic. Le diagnostic de bronchectasies est posé, il faut chercher une étiologie accessible à un traitement spécifique. Un petit nombre d’étiologies (10-12 %) est accessible à un traitement spécifique qui sera associé au « socle thérapeutique » : substitution en Ig, corticothérapie et/ou antifongiques si ABPA, correction d’un déficit en alpha-1-antitrypsine ?
Quelques examens de 1re intention permettent d’avancer (figure 3) ?
Figure 3. Bilan de 1re ligne des bronchectasies.
FNS : neutropénie ? Lymphopénie ? Hyperéosinophilie ? Pourront orienter vers un déficit immun ou une ABPA (aspergillose broncho-pulmonaire allergique).
Dosage pondéral des Ig et des sous-classes d’IgG → déficit immun ? IgE totales → ABPA ? Sérologie aspergillaire, IgE spécifiques aspergillaires (ou tests cutanés aspergillaires) → ABPA ou bronchite aspergillaire ?
Examens de débrouillage pour une connectivité ou une vascularite (facteurs rhumatoïdes, aC anti-CCP, ACAN, ANCA).
Selon les résultats de ces 1ers bilans, l’histoire et l’examen cliniques, des investigations plus spécialisées pourront compléter la recherche étiologique orientée par l’interrogatoire et la symptomatologie clinique :
– consultation dans un CRCM (centre de ressources et de compétences pour la mucoviscidose) dont c’est le rôle d’affirmer ou d’éliminer une telle pathologie. Un test de la sueur et enquête génétique pourront ainsi être demandés, devant un hippocratisme digital, atteinte ORL associée, symptômes évoluant depuis l’enfance, une hypoplasie sinusienne, prédominance apicale des bronchectasies… ;
– avis auprès d’un centre de maladies rares pulmonaires, à la recherche d’une dyskinésie ciliaire primitive pour mesure d’un NO nasal et (DCP, topographie antérieure et lobaire moyenne des bronchectasies, atteinte ORL, hypofertilité, détresse néonatale ?) ;
– recherche de déficit en alpha-1-antitrypsine en cas de cas familiaux ou d’emphysème associé.
On distingue les bronchectasies non idiopathiques pour lesquelles une étiologie a été mise en évidence pour 62 % des 16 963 participants du registre EMBARC, parmi lesquelles les bronchectasies post-infectieuses (infections de la petite enfance ou plus tardives, coqueluche, pneumonies) sont les plus fréquentes (21 % des patients) puis viennent des causes plus rares. En l’absence d’étiologie retrouvée, on posera le diagnostic de bronchectasies dites idiopathiques, qui représentent plus d’un tiers des cas (38 %), avec des variations selon les pays et le degré d’exploration de l’étiologie(3) (figure 4).
Figure 4. Étiologies des bronchectasies en Europe (données du registre EMBARC, d’après 3).
Quelle que soit l’étiologie, il faut évaluer l’impact de la maladie bronchectasiante
Impact des symptômes au quotidien qui vont dégrader la qualité de vie :
– la toux chronique productive est présente dans 90 % ;
– les hémoptysies : signalées par 2/3 des patients, souvent peu abondantes ;
– l’asthénie chronique est fréquente ;
– les douleurs thoraciques précèdent souvent une exacerbation ;
– la dyspnée est variable et dépend de l’étendue des lésions et du degré d’encombrement bronchique, du degré de déconditionnement ;
– la fréquence des exacerbations et du recours à l’antibiothérapie.
L’examen clinique recherchera un hippocratisme digital, des signes objectifs de rhinite associée (voix nasonnée, rhinorrhée, hypoacousie, perte ancienne de l’odorat, infections ORL récidivantes, allergies associées).
Évaluer le diagnostic microbiologique : quels sont les pathogènes isolés ? (tableau)
Une analyse mycobactériologique est indispensable — on sait que Pseudomonas aeruginosa est un facteur pronostique défavorable (majoration de la fréquence des exacerbations, les admissions hospitalières, dégradant la qualité de vie).
Des mycobactéries atypiques sont-elles isolées ?
Des moisissures ? En particulier Aspergillus fumigatus. Chez le patient ne sachant pas ou n’arrivant pas à expectorer, même avec l’aide d’un kinésithérapeute, une endoscopie bronchique pourra être proposée pour un diagnostic microbiologique.
Impact fonctionnel respiratoire via l’EFR :
– quel est le niveau d’obstruction bronchique ?
– est-il réversible (témoignant d’une composante asthmatique associée) ?
– quel comportement à l’effort ? Faut-il envisager une réhabilitation ?
Chercher des comorbidités à traiter : atteinte ORL, cardiovasculaire, RGO, BPCO, incontinence urinaire à la toux, dénutrition, et les traiter.
Chercher des facteurs de mauvais pronostic
Le type de colonisation bactérienne, en particulier la présence de Pseudomonas aeruginosa.
Le taux annuel d’exacerbations ≥ 3/an, définissant un « phénotype » exacerbateur fréquent.
La sévérité de l’atteinte fonctionnelle respiratoire.
L’association à une BPCO post-tabagique. Des scores de sévérité existent et peuvent aider à évaluer le pronostic comme le BSI ou le score FACED(4).
C’est donc une véritable carte d’identité de la bronchectasie pour un patient donné qui va être obtenue et permettre de décliner la stratégie thérapeutique comportant un socle commun à toutes les étiologies et parfois des thérapeutiques plus individualisées en cas de déficit immun (substitution), d’ABPA.
Quels sont les principes thérapeutiques fondamentaux ?
Prévenir les exacerbations qui aggravent le pronostic et ralentir ainsi la progression de la maladie respiratoire.
Limiter les complications liées à des antibiothérapies répétées. Réduire les symptômes quotidiens.
Améliorer la qualité de vie.
La prise en charge non médicamenteuse est importante, mais contraignante pour le patient
• Hydratation suffisante > 1,5 litre d’eau par jour pour fluidifier les secrétions et permettre un drainage bronchique plus aisé.
• Drainage bronchique quotidien ou pluri-hebdomadaire en autodrainage après apprentissage ou chez un professionnel formé à la kinésithérapie respiratoire (multiplicité des techniques selon le niveau d’atteinte fonctionnelle, l’étendue des bronchectasies , la présence ou non d’une dyskinésie trachéobronchique, recours à des aides instrumentales…).
• Reconditionnement à l’effort et pratique d’une activité physique régulière.
• Prévention vaccinale antigrippale, antipneumococcique, anti-Covid.
• Sevrage tabagique.
• Traitement d’une pathologie ORL chronique associée (lavage régulier des fosses nasales), soins dentaires si besoin.
• Optimisation nutritionnelle.
PRENDRE EN CHARGE RAPIDEMENT UNE EXACERBATION
C’est un événement fréquent puisqu’un patient sur 2 présente au moins 2 exacerbations/an dont un tiers requiert une hospitalisation. Ces exacerbations sont responsables du coût économique de la prise en charge des bronchectasies, notamment en hospitalisation. C’est également un facteur de préoccupation majeure du patient et source de dégradation progressive de la maladie.
Il faut donc savoir la définir : c’est une dégradation aiguë sur plusieurs jours, incitant à une modification de la prise en charge avec une modification d’au moins 3 symptômes depuis au moins 48 heures parmi les suivants : toux, expectoration (en volume et/ou en aspect), purulence, dyspnée et/ou tolérance à l’exercice, fatigue ou malaise, hémoptysie incitant le médecin à une modification de la prise en charge(5).
Le facteur déclenchant est souvent viral en hiver. Le traitement repose sur : l’optimisation du drainage bronchique, une antibiothérapie adaptée aux pathogènes connus du patient pendant une durée prolongée de 10 à 14 jours(4). Sauf bronchospasme associé, il n’y a pas d’indication à une corticothérapie par voie orale dans ces exacerbations.
NB : En dehors d’un asthme associé, l’inhalation de corticostéroïdes inhalés n’est pas conseillée. Les bêta de courte durée d’action sont souvent inefficaces. Les parasympatholytiques n’ont pas démontré d’intérêt thérapeutique et peuvent contribuer à assécher les sécrétions bronchiques.
En cas de primocolonisation à P. aeruginosa, un traitement d’éradication est préconisé par les recommandations européennes, compte tenu de l’impact péjoratif de l’infection chronique à P. aeruginosa en termes de morbidité et de mortalité (x 6). Le schéma optimal n’est pas connu, mais intègre des nébulisations de colistine. Des études sont en cours(4).
Quel bilan en cas d’exacerbations récidivantes ?
• S’assurer de la réalisation des soins quotidiens.
• Chercher une pathologie fongique associée : APBA, aspergillose pulmonaire chronique ? Bronchite aspergillaire.
• Vérifier l’absence de mycobactérie atypique.
• Vérifier l’absence de comorbidité cardiovasculaire confondante avec la pathologie respiratoire.
• Une fois ces éléments éliminés pourra se discuter la place des macrolides ou des traitements antibiotiques inhalés.
• En cas de bronchectasies localisées, une chirurgie d’exérèse du foyer peut être discutée.
Quand proposer des macrolides ?
Chez les exacerbateurs fréquents, c’est-à-dire les patients présentant au moins 3 exacerbations/an, sous réserve d’une prise en charge non médicamenteuse optimale (hydratation, drainage bronchique), que le patient soit porteur ou non de P. aeruginosa. C’est l’azithromycine qui est le plus fréquemment utilisée, à faible dose pendant une durée d’au moins 3, voire 6 mois pour pouvoir juger de l’efficacité sur la fréquence et le délai entre exacerbations. Il s’agit d’une prescription hors AMM, le patient doit en être informé. Le patient n’est pas porteur d’une mycobactérie atypique (qui doit donc être systématiquement recherchée avant traitement) afin de limiter le risque de sélection de souches résistantes par un traitement en monothérapie en cas d’isolement. Une vérification du segment QTc sur l’ECG est indispensable (risque de torsades de pointe), vigilance en cas d’association médicamenteuse avec un traitement pouvant influencer ce segment.
Quand proposer des nébulisations d’antibiotique et lequel ?
Le plus fréquemment utilisé est la colistine sous forme nébulisée ; elle a fait l’objet de plusieurs publications récentes montrant une efficacité sur la réduction du nombre d’exacerbations et le délai de survenue de celles-ci, en améliorant la qualité de vie. Les autres molécules ayant fait l’objet d’études sont la tobramycine, l’amikacine et la gentamicine. Aucune molécule n’a l’AMM en France dans cette indication (ni ailleurs). La tolérance peut être difficile chez certains patients avec toux et bronchospasme. L’administration biquotidienne a pour objectif de limiter le nombre d’exacerbations, notamment sévères chez les patients exacerbateurs fréquents (≥ 3/an) colonisés à P. aeruginosa. Il ne s’agit donc que d’un petit nombre de patients. La compliance à ce traitement est de l’ordre de 50 %. La nébulisation est d’autant plus efficace que le patient est bronchorréïque.
MALADIE CHRONIQUE = SUIVI RÉGULIER
L’éducation thérapeutique a toute sa place dans cette pathologie chronique.
Un suivi pneumologique au moins annuel est recommandé. Il permet de refaire un point thérapeutique (adhésion, nombre d’exacerbations, nouveaux symptômes, suivi du drainage, nouvelles comorbidités…), « écologique » (examen microbiologique annuel) et fonctionnel respiratoire, iconographie (TDM thorax en cas de modification des symptômes).
Quel avenir dans la stratégie thérapeutique ?
Associée à une prise en charge globale indispensable, en grande partie non médicamenteuse, vers une médecine de précision, individualisée, en définissant au mieux les phénotypes (à partir des caractéristiques cliniques comme les exacerbateurs fréquents ou non), mais aussi les endotypes (mécanismes physiopathologiques et biologiques de la maladie)(6) : profil TH1 avec la voie de l'inflammation bronchique à polynucléaires neutrophiles, cible de nouvelles thérapeutiques comme le brensocatib en cours d’essai, ou la voie TH2, plutôt à éosinophiles, pouvant faire discuter une place pour les biothérapies ; sans oublier de traiter des causes spécifiques ou des comorbidités associées pouvant dégrader le tableau (RGO par exemple).
CONCLUSION
• En synthèse : la dilatation de bronches est une maladie respiratoire chronique sévère, altérant la qualité de vie, source de morbidité respiratoire et de surmortalité respiratoire et extra-respiratoire.
• Son traitement est quotidien, lourd, chronophage. Une meilleure compréhension des mécanismes physiopathologiques ouvre de nouvelles options thérapeutiques plus individualisées.
Liens d’intérêts en relation avec cet article : collaboration au cours des trois dernières années avec Insmed, Viatris, Zambon.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :