Publié le 22 jan 2014Lecture 10 min
Quelle stratégie dans la prise en charge des épistaxis ?
O. MALARD, Service d’ORL et de chirurgie cervico-faciale, CHU de Nantes
L'épistaxis est un saignement des cavités naso-sinusiennes qui survient avec une incidence élevée, puisque entre 5 et 10 % de la population est concernée tous les ans. Dans la très grande majorité des cas, il s’agit de formes tellement banales que le patient ne consulte pas, et seulement 1 % des épistaxis donneraient lieu à une consultation spécialisée. Un saignement survenant au niveau d’une ectasie de la tache vasculaire est l’étiologie la plus fréquente. Il est essentiel de différencier les formes bénignes, le plus souvent unilatérales, qui présentent une extériorisation antérieure, et les formes graves, rares, volontiers postérieures et bilatérales qui ne cèdent pas aux mesures de compression simple et comportent un risque hémodynamique.
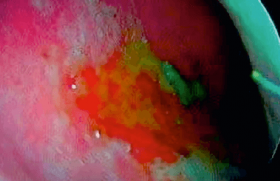
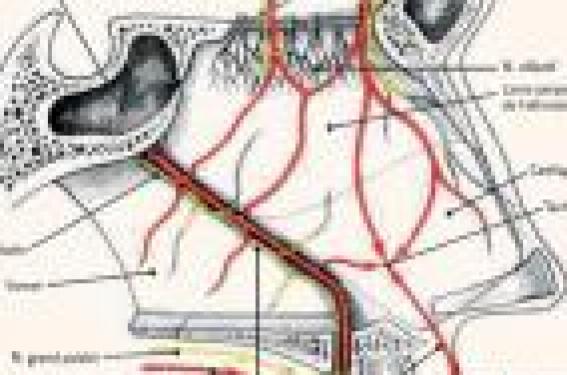
Lors de la prise en charge, l’évaluation des déperditions sanguines et leur retentissement hémodynamique sont deux éléments à préciser et prendre en compte rapidement, quelle que soit la cause du saignement. En urgence, le but est bien sûr d’obtenir le tarissement du saignement, tout en recherchant rapidement, par un examen rhinoscopique et des examens systémiques, en particulier d’hémostase, une étiologie ou un facteur de gravité particuliers. Le diagnostic d’épistaxis idiopatique doit être posé par élimination. Le diagnostic, les étiologies Par définition, et étymologiquement, l’épistaxis est une hémorragie ayant pour origine les cavités naso-sinusiennes, ce qui exclut l’extériorisation de sang d’origine buccale, respiratoire ou digestive (le diagnostic différentiel peut cependant être difficile en décubitus, chez des patients en milieu de réanimation…). Les étiologies sont très nombreuses. Les causes locales • L’ectasie vasculaire localisée ou « ectasie de la tache vasculaire » dite de Kiesselbach est une zone d’anastomoses de branches terminales de la carotide interne et de la carotide externe homolatérales. L’artère naso-palatine et de la sous-cloison s’anastomosent avec les branches de l’artère ethmoïdale antérieure dans la partie antéro-inférieure de la cloison, au niveau d’une zone de fragilité saignant fréquemment(1) (figure 1). Figure 1. Vascularisation des fosses nasales (d’après F. Legent). • Post-traumatiques aiguës : post opératoire (turbinectomie, ethmoïdectomie), fracture des OPN, disjonctions crânio- faciales… post-traumatique retardée (après un intervalle libre), faisant craindre une fistule artério-veineuse. • Tumeurs bénignes : largement dominées par le fibrome nasopharyngé (homme jeune, figure 2) et les tumeurs vasculaires (de type hémangiome ou hémangiopéricytome, figure 3, illustration). Les autres tumeurs bénignes (polypose nasale…) ne donnent habituellement pas d’épistaxis. Figure 2. Angiofibrome nasopharyngé (flèche), chez un jeune patient de 18 ans. A. Rhinoscopie antérieure. B. Cavoscopie. Figure 3. Épistaxis liées à un hémangiopéricytome nasal droit. • Tumeurs malignes : carcinome indifférencié du cavum (contexte ethnique), adénocarcinome de l’ethmoïde (menuisier, figure 4), tumeurs rares (figure 5 : autres carcinomes, esthésioneuroblastome, mélanome, lymphome, rhabdomyosarcome chez l’enfant…). Figure 4. Adénocarcinome ethmoïdal gauche. A. Aspect endoscopique. B. Examen TDM. C. Examen IRM. • Maladie de Rendu-Osler (angiomatose familiale hémorragique) entraînant la formation d’angiomes multiples récidivants nasaux et extra-nasaux (figures 6 et 7). • Infection aiguë : infections nasosinusiennes (épistaxis transitoires concomitantes) ; infection chronique (ex. : aspergillose). • Toxique/médicamenteuse : utilisation prolongée de topiques vasoconstricteurs, cocaïne. Figure 5. Épistaxis liées à un lymphome nasal gauche. Les causes générales • Les troubles de la coagulation : thrombopathie acquise ou congénitale (Willebrandt), thrombopénie, anticoagulation (surtout en cas de surdosage) peuvent se révéler par une épistaxis (2) (avec ou sans lésion des fosses nasales). • L’hyperpression artérielle est souvent incriminée, mais il est bien difficile de savoir s’il s’agit d’une réelle cause indépendante(3,4) et les travaux publiés sont contradictoires. L’hyperpression peut aussi survenir dans le contexte et en conséquence de l’épistaxis (anxiété du patient). • L’épistaxis « idiopathique », c’est un diagnostic d’élimination. L'éxamen clinique La gravité immédiate d’une épistaxis sévère est liée à l’hypervolémie et au choc qui peut survenir(5): la tolérance et le retentissement systémique sont les premiers éléments à vérifier : hémodynamique (pouls, PA), état respiratoire (fréquence, dyspnée, sueurs, saturation, céphalées), neurologique (conscience, agitation). Il faut s’efforcer d’évaluer les pertes : durée d’évolution ? Quantifier : nombre de haricots, mouchoirs ? L’interrogatoire et les antécédents sont essentiels : profession, traumatisme crânio-facial y compris ancien, traitement anticoagulant ?… Figure 6. Maladie de Rendu-Osler, nombreux angiomes diffus de la fosse nasale. Chez ce patient, il existait une polypose naso-sinusienne associée, totalement indépendante du point de vue épidémiologique. Un examen local est effectué si possible après mouchage bilatéral (rôle hémostatique) et éventuel méchage vasoconstricteur par rhinoscopie antérieure : localisation du saignement, latéralité ? Ectasie de la tache vasculaire ? Artériole ? Saignement sur la paroi pharyngée postérieure ? Les examens complémentaires Ils ne sont pas systématiques, en particulier en cas de simple ectasie de la tache vasculaire, et en fonction du contexte et de la tolérance : NFS, plaquettes, hémoglobinémie (sa chute est différée après le délai de l’hémodilution), thrombopénie ? INR, TCA : qualité de la coagulation ? Ionogramme sanguin : surtout utile avant le début des perfusions de solutés de remplissage. Groupe ABO, rhésus, recherche d’agglutinines irrégulières : afin d’anticiper une éventuelle transfusion. La prise en charge • Patient demi-assis, rétablir et maintenir l’hémodynamique (les complications des épistaxis graves sont liées aux défaillances hémodynamiques et leurs complications multiviscérales) : garantir un abord veineux de bon calibre (double en cas d’épistaxis sévère), assurer un remplissage vasculaire (par macromolécules en tenant compte d’une éventuelle insuffisance cardiaque préalable) ; traiter une hyperpression artérielle associée et une anxiété importante (benzodiazépine). Figure 7. Localisations linguales d’angiomes dans la maladie de Rendu-Osler. • Hospitalisation non systématique, dépendant de la gravité de l’épistaxis et de sa cause. • Contrôle du saignement : des moyens graduels et adaptés à l’étiologie suspectée sont proposés successivement en cas d’échec du palier antérieur : – mouchage des fosses nasales : diminue et stoppe parfois de petits saignements, puis pincement des ailes du nez 5 à 10 minutes, suffisant pour une ectasie de la tache vasculaire (une cautérisation est effectuée secondairement, un méchage vestibulaire quelques heures peut être mis en place) ; – tamponnement antérieur : en cas d’échec des manoeuvres précédentes, effectué à l’aide de mèches résorbables (Surgicel…) ou non (Tulle Gras…), permet d’appliquer une pression sur la muqueuse de toute la fosse nasale en avant des choanes. En cas de troubles de la coagulation, des mèches résorbables sont utilisées préférentiellement puis rapidement humidifiées. Une antibiothérapie prophylactique classique n’est pas indispensable pour des méchages de 48 heures. L’efficacité est vérifiée : arrêt du saignement antérieur, absence de saignement postérieur. En cas d’échec, il faut revérifier le côté du saignement, au moindre doute effectuer un tamponnement controlatéral. Si le saignement persiste, le tamponnement peut être renouvelé, plus serré, après un nouveau mouchage ; Figure 8. Sténose des ailes du nez secondaire à une ischémie par tamponnement antérieur et postérieur par sonde à double ballonnet. A. Forme incomplète bilatérale. B. Forme complète droite. – le tamponnement postérieur : compression hémostatique du rhinopharynx (cavités nasales rétro-choanales), toujours associée à un tamponnement antérieur, le plus souvent réalisé sous anesthésie générale. Plusieurs techniques sont possibles : tamponnement à la compresse ou à l’aide de sondes à double ballonnet. La compression est allégée puis progressivement retirée avant 48 heures (risque de nécrose du septum, des ailes du nez, figure 8). En cas d’échec du tamponnement, ou de récidive lors de son ablation, deux méthodes sont utilisables, dont l’indication dépend du contexte : • l’artériographie-embolisation qui permet d’emboliser sélectivement les branches du territoire carotidien externe (A. maxillaire et sphéno-palatine, faciale). Elle ne permet pas de geste sur les vaisseaux ethmoïdaux qui dépendent du territoire interne. L’artériographie est surtout proposée dans les contextes traumatiques, les terrains précaires (parfois réalisable sous anesthésie locale), mais également dans les formes sévères idiopathiques (figure 9). Les complications sont très rares, mais doivent être exposées au patient : la plus grave est l’accident vasculaire ischémique (< 0,5 %)(6). Les nécroses nasales sont exceptionnelles (figure 10). Les douleurs post-embolisation ne sont pas exceptionnelles et parfois prolongées. • le traitement chirurgical : il permet les ligatures des territoires précédents par abord endonasal, ainsi que des artères ethmoïdales par abord externe (canthotomie). C’est la méthode de choix en cas d’épistaxis postopératoire, ou en cas d’échec de l’embolisation(7). • L’attitude vis-à-vis de la prise d’éventuels antiagrégants ou anticoagulants : – les antiagrégants peuvent être suspendus, notamment si un geste chirurgical doit être entrepris au cours de la prise en charge. Cependant, leur durée d’action est telle que lorsque l’épistaxis est rapidement contrôlée et ne présente pas de critères de gravité, ils peuvent être maintenus (balance bénéficerisque) ; – les anticoagulants doivent être suspendus définitivement dès que le bénéfice de leur indication n’est pas clairement établi (phlébite très ancienne…). Lorsque l’indication est formelle (valve cardiaque mécanique, embolie pulmonaire récente, déficit en protéine C, S…), un relais par une héparinothérapie hypocoagulante est effectué jusqu’au contrôle de l’épistaxis. Dans le cas d’épistaxis de faible abondance rapidement contrôlées, les anticoagulants peuvent être maintenus. Figure 9. Principales étiologies d’épistaxis conduisant à une embolisation (d’après(7)). Figure 10. Nécrose de la pointe nasale dans les suites d’une embolisation faciale et maxillaire bilatérale. A. Aspect à J2. B. Aspect à J15. • Les transfusions sanguines sont parfois nécessaires : – transfusions de plaquettes (thrombopénie centrale) lorsque la numération plaquettaire est inférieure à 30 000/mm3. Leur efficacité dépend de la cause de la thrombopénie. Dans les coagulopathies de consommation, leur efficacité est faible et leur indication discutable ; – transfusions de culots globulaires phénotypés : l’indication se discute lorsque l’hémoglobinémie est inférieure à 7 ou 8 g/dl mais dépend en fait de la tolérance individuelle du patient à l’anémie et du terrain (âge, antécédents de dyspnée, d’angor, etc.). • Le traitement causal : il est évidemment indispensable (traitement d’une tumeur, aspergillose, traumatisme, etc.). • Cas particulier de la maladie de Rendu-Osler. Des recommandations ont été apportées par la HAS(8,9) : – les critères diagnostiques de Curaçao sont : un diagnostic formel si 3 critères sont présents, et un diagnostic suspecté si seulement 2 critères sont retrouvés parmi les suivants : Critères de Curaçao : • Épistaxis : spontanées, récurrentes. • Télangiectasies : multiples, sites caractéristiques (lèvres, bouche, doigt, nez). • Lésions viscérales : tube digestif (télangiectasies). • Malformations artério-veineuses (MAV) : pulmonaires, hépatiques, cérébrales/spinales. • Antécédents familiaux 1er degré. • Sur le plan génétique, 2 mutations génétiques ont été identifiées au niveau du récepteur du TGF-β: – celle de l’Endoglin (ENG) sur chromosome 9(8) ; – celle de l’Activin A receptor type II-like 1 (ACVRL1) on chromosome 12(9). Ces deux mutations codent électivement pour les formes HHT1 (associée aux MAV pulmonaires) et HHT2 (forme moins sévère). Il a été démontré une augmentation du VEGF chez les patients malades, qui est à l’origine de nouvelles bases thérapeutiques reposant sur des anticorps monoclonaux anti-VEGF(10-12). • Le bilan initial de la maladie et son suivi sont résumés dans le tableau, selon les recommandations de la HAS.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :